聖諾制藥公佈STP705治療皮膚原位鱗狀細胞癌臨床二期試驗中期分析報告的頂線陽性數據

聖諾制藥於今天公布:其首選核酸干擾創新藥STP705在目前進行的治療皮膚原位鱗狀細胞癌(squamous cellcarcinoma in situ,isSCC)二期臨床試驗的中期分析報告中顯示頂線陽臨床數據。
聖諾制藥是一家致力於發現和開發針對癌症和纖維疾病的核酸干擾(RNAi)藥物國際領先企業。該公司今天宣佈,其正在進行的臨床IIa期研究的核酸干擾創新藥STP705,在治療非黑色素瘤性皮膚癌,專門針對原位鱗狀細胞癌試驗的中期分析報告中顯示明確的有效性和安全性結果。在對前三個劑量組的的研究結果分析表明:大部分受試者在接受STP705藥物治療後,可觀察到原位皮膚鱗狀細胞癌的徹底組織學清除,達到了臨床試驗的主要終點。
這項開放標籤、劑量遞增的臨床研究旨在評估不同劑量的STP705通過皮膚原位鱗狀細胞癌腫瘤病灶中注射給藥的安全性、耐受性和療效。該試驗由5個劑量遞增組,劑量從10μg到120μg,每組5名患者,總共25名患者將被納入本項試驗。受試患者須每週給藥一次,持續6周。中期分析報告包括前三組接受10μg、20μg和30μg用藥劑量水準治療效果。中期分析獲取樣本數據的截止日期為2020年3月2日。
本試驗的主要終點是評價患者在接受治療後的皮膚原位鱗狀細胞癌腫瘤病變是否完全的組織學清除。根據前三組試驗結果的中期分析報告,66%的患者(10/15)獲得了完全的組織學清除。10微克和20微克治療組均有3例(60%,3/5)達到組織學清除,而30微克治療組有4例(80.0%,4/5)達到完全的組織學清除,且呈劑量依賴性。
STP705在關鍵的次要終點的安全性評估上顯示出良好結果。研究中沒有出現與試驗藥物治療相關的不良事件,也沒有嚴重的不良事件報告。特別重要的是,治療組沒有發現明顯的局部皮膚反應。目前,另外兩個更高劑量組(60微克和120微克)的臨床試驗正在推進,並希望通過這兩組試驗確認最佳的治療劑量窗口。
聖諾制藥總裁兼首席執行官陸陽博士指出: “我們首個核酸干擾創新藥,在腫瘤學臨床研究中期分析的結果令人振奮,也是我們多年來創新創業的重要里程碑。尤其是試驗中大部分患者在用藥治療後,達到主要終點並呈現劑量依賴性的效果,不僅顯示了核酸干擾(RNAi)療法在腫瘤治療中的巨大潛力,而且也驗證了多肽納米製劑用於小干擾核酸(siRNA)藥物導入技術的安全性和有效性。本次試驗的頂線治療效果進一步驗證了TGF-β1作為腫瘤治療靶點的重要性,以及聖諾制藥雙靶點核酸干擾研發策略在腫瘤治療領域的成功。” 陸陽博士強調:”這項臨床研究中期分析報告中所展示的這些療效和安全性結果,進一步奠定了我們在核酸干擾藥物癌症治療領域的國際領先地位。”
聖諾制藥首席醫學官Michael Molyneaux醫學博士說:“這項研究中期分析報告的結果非常令人鼓舞,因為我們達到並且驗證了高比例腫瘤病灶組織清除率是皮膚癌治療的金標準。同時獲得了療效與安全性之間良好的結合。最重要的是,試驗表明沒有局部皮膚反應,這對患者和臨床醫生至關重要,因為這一治療手段為替代手術切除病變的傳統方法提供了安全有效的選項。”
美國邁阿密大學醫學院教授,臨床和美容研究中心主任,本項臨床研究的負責人Mark Nestor醫學及科學博士指出"原位鱗狀細胞癌目前的治療標準是手術切除,或者破壞,或者放射治療。而通過一種非手術、無疤痕,注射治療手段同時對病患更為有益的選擇,將改變那些非黑素瘤皮膚癌治療的傳統觀念和模式。"
關於非黑色素瘤皮膚癌(NMSC)和原位鱗狀細胞癌(isSCC)
皮膚癌是美國每年診斷出的所有癌症中最常見的一種。據估計,每年確診的癌症中有近一半是皮膚癌。在過去的十年裏,皮膚癌的發病率急劇上升。對美國NMSC發病率的最佳估計是基於美國醫學會刊《JAMA》皮膚病學雜誌的論文(Rogers et.al, 20151511081-1086),估計在美國人口中每年會有330萬人患有非黑色素皮膚癌,共有543萬個癌症病例。非黑色素皮膚癌包括基底細胞癌255萬例(47%)和鱗狀細胞癌257萬例(46.7%),以及另外不同類型的皮膚癌332000例。根據適應症類型,非黑色素瘤癌症由於患者數量眾多,佔據了最重要的市場價值。根據“Datamintelligence.com”的市場研究報告,非黑色素瘤皮膚癌每年的市場潛力估計約為48億美元。
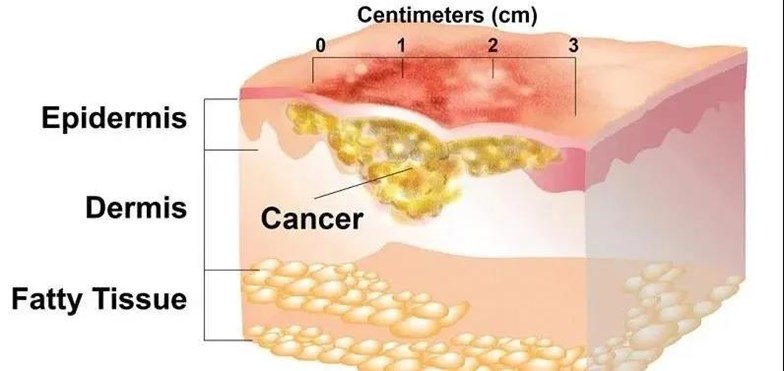
原位鱗狀細胞癌,又稱鮑恩病,是鱗狀細胞皮膚癌(SCC)的最早形式。鱗癌與基底細胞癌是非黑色素瘤性皮膚癌的兩個主要亞型之一。鱗狀細胞癌的發生與影響鱗狀細胞譜系承諾和終末分化的基因組微擾、基因突變和關鍵分子表達改變(如TGF-β1和COX-2的過度表達)密切相關。鱗狀細胞癌最常見的發生部位是面部、頸部、禿頭、前臂伸肌、手背和脛骨。目前手術是治療非黑色素瘤的傳統治療方法。單純手術切除成功率低,復發率高30%, 而且各種形式的手術方式都會帶來嚴重的皮膚不良事件、疤痕、感染和出血的風險。應注意的是,由於疤痕、出血、與手術相關的感染風險以及相關的附帶考慮/成本,注射用藥治療的安全有效行比手術治療更可取。
有關本臨床試驗的更多資訊,請訪問網址:clinicaltrials.gov,臨床試驗號為:NCT04293679。
[關於STP705]
聖諾制藥領先的候選產品STP705是一種siRNA(小干擾RNA)治療藥物,它利用雙重靶向抑制特性和多肽納米粒(Peptide-Nano particle,PNP)增強小干擾核酸的體內導入,直接降低TGF-β1和COX-2基因的表達。該候選產品已獲得美國FDA和中國NMPA的多項IND批准,包括膽管癌、非黑色素瘤皮膚癌和增生性瘢痕的治療。STP705還獲得治療膽管癌和原發性硬化性膽管炎的孤兒藥認證。使用STP705的臨床前動物模型已經證明,在單藥作用下,T細胞在肝臟腫瘤中的滲透性顯著改善,並且抗PD-L1抗體檢查點抑制劑在HCC模型中的療效也有改善。除了針對PD-1/PD-L1軸的作用外,這種作用還可能提高其他免疫檢查點抑制劑的作用。
聖諾制藥是一家註冊於美國特拉華州、總部位於美國馬里蘭州、在中國蘇州和廣州設有分公司的核酸新藥創制的領軍企業。公司的使命是開發創新療法,減輕病患痛苦,增進人類健康,並在高未滿足醫療需求領域推進患者護理。公司的宗旨是:創新引領,全球視野,病患第一。高層管理團隊的成員在美國和中國的生物制藥行業、金融、臨床和商業管理方面有著豐富的綜合經驗。該公司的資金來自機構投資者、企業合作夥伴和基金支持。聖諾制藥擁有國際領先的核酸藥物導入技術和新藥創制及產業化平臺,並具有堅實的知識產權組合和豐富的產品線。重點治療領域包括腫瘤和纖維化疾病的治療。
更多資訊可訪問:www.sirnaomics.com.





 返回新聞發佈
返回新聞發佈
 上一頁
上一頁
