聖諾制藥首個抗腫瘤核酸干擾創新藥獲美國FDA批准用於肝膽管癌治療臨床研究
美國PRNews新聞社
2018年8月16日發自美國馬里蘭蓋瑟斯堡
聖諾制藥公司今天宣佈,該公司首個用於腫瘤治療的核酸干擾創新藥的臨床申報(IND)獲得美國FDA的批准。此項申報是推進核酸干擾藥物科特拉尼(STP705)用於晚期肝膽管細胞癌(CCA)治療的臨床研究。聖諾制藥是一家專注核酸干擾(RNAi)藥物創制的生物制藥公司。
科特拉尼(STP705)是一個抗腫瘤和抗纖維化的小干擾核酸(siRNA)治療藥物,通過利用雙靶點小干擾核酸和專有的多肽納米顆粒(PNP)導入系統來增強肝細胞和腫瘤細胞靶向。STP705在腫瘤微環境中能夠有效抑制TGF-β1和COX-2兩個基因的表達,可以降低腫瘤相關成纖維細胞(CAF)的活性和細胞的增殖,得以直接阻斷腫瘤生長。2017年8月和12月,STP705用於治療肝膽管癌(CCA)和原發性硬化性膽管炎(PSC)的臨床指症分別獲得了美國FDA“孤兒藥”開發辦公室(OOPD)認證的“孤兒藥”資格。此前,該產品的不同劑型用於治療皮膚增生性瘢痕,已獲得了美國FDA和中國CFDA的IND批准,分別進入臨床二期和臨床一期。基於STP705的治療機理,該藥物很有可能在多種疾病和多個治療領域具有廣泛應用的前景。
“聖諾制藥首個用於腫瘤治療的核酸創新藥獲得美國FDA的臨床批准,代表了我們公司在研發創制核酸干擾創新藥物奮進中的又一個重大里程碑。基於在抗纖維化治療方面已經積攢的經驗,我們在藥物靶點的選擇和腫瘤靶向給藥技術這兩項關鍵技術支撐下,能夠更為有效地通過核酸干擾技術為抗腫瘤治療提供了一個全新的選項,” 公司創始人兼首席執行官陸陽博士如是說。“最近Alnylam公司的Patisiran®作為首個核酸干擾藥物成功獲得NDA(New Drug Application)批准上市,是對整個核酸干擾新藥創制領域的巨大鼓舞。我們相信致力於這一領域的專家們會投入更大的熱情,積極推動核酸干擾藥物創制,為病患提供更好的治療手段。此刻,我們堅信聖諾制藥已經在抗腫瘤和抗纖維化的核酸新藥創制領域處於全球引領地位。”
“膽管癌是一種預後極差的肝癌,死亡率很高,尚無有效的治療方法。基於我們已有的臨床前數據,我們非常希望STP705會對這種疾病的治療產生積極影響,真正達到我們開發臨床急需新藥的目標,” 聖諾制藥首席醫學官Michael Molyneaux醫學博士說。“我們預期通過嚴謹的臨床研究設計,能夠加深瞭解STP705對CCA的影響。目前的研究數據表明,STP705給藥後能夠很好地在肝臟部位富集,同時具有非常好的安全性。我們希望通過這項研究將使我們推進瞭解其他形式的肝癌和纖維化疾病,以支持我們在腫瘤治療和纖維化疾病治療領域的進一步藥物研發。”
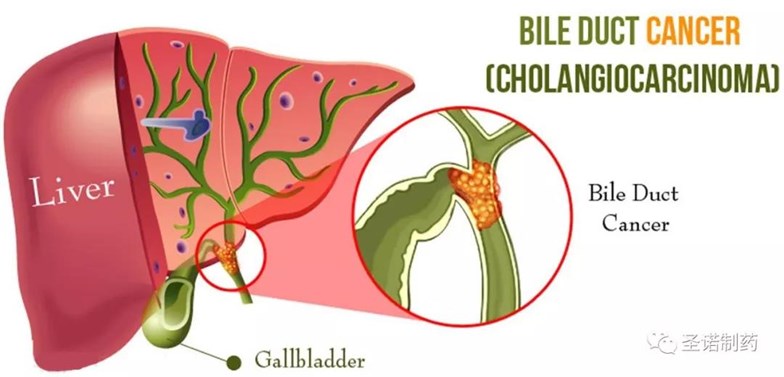
關於肝膽管癌(CCA)
肝膽管癌(CCA)是排名第二的肝臟原發性惡性腫瘤(占肝癌的15~20%)。CCA又稱膽管腺癌和膽道癌。雖然在亞洲更常見,但在歐洲和美國北部的發病率在最近幾十年顯著增加。CCA的特點是大部分病人確診時已經入晚期和極高的致命性,5年生存率範圍為2-30%。CCA是起源於轉化的膽管上皮細胞惡性腫瘤,臨床前研究表明肝原代細胞為起源細胞。炎症和膽汁淤積是膽管癌發生的關鍵因素。研究結果還表明TGF-β1的高表達是誘導癌細胞侵襲、新生血管生成、細胞增殖和某些腫瘤轉移的致癌因素。環氧合酶-2(COX-2)在CCA的發病過程中起著促進血管生長的作用,啟動數個生長因數表達,比如MAPK、表皮生長因數受體(EGFR)和白細胞介素6(IL-6)。
關於科特拉尼(STP705)
STP705由兩個siRNA寡核苷酸組成,分別以TGF-β1和COX-2的mRNA為靶標,並通過與組氨酸賴氨酸多肽共聚物(HKP)形成納米粒,促進更為有效的細胞導入。試驗證明每個單獨的siRNA可以高效抑制其靶標mRNA的表達,兩個siRNA的結合則產生協同作用,減少原發性纖維化和促炎因數表達。分子生物學分析表明,這些靶點的抑制對與纖維化相關的下游基因表達產生影響,這些基因包括:α-SMA、COL1A1和COL3A1。試驗數據還表明同時抑制TGF-β1和COX-2基因表達可以誘發成纖維細胞的凋亡。最新文獻表明,TGF-β1與腫瘤微環境中的T細胞衰竭、PD-L1和CTLA-4上調據有直接關係。這些結果提示,STP705在多種纖維化和癌症疾病中有廣泛的應用前景。用STP705處理肝內膽管癌細胞系HuCCT-1的細胞培養實驗表明,這個藥物具有顯著的靶基因敲除和腫瘤細胞殺傷作用。HKP增強的核酸干擾藥物的遞送在肝細胞、肝竇內皮細胞(LSEC)和肝星狀細胞(HSC)中顯示出優先分佈。在小鼠模型中採用靜脈注射HKP/siRNA納米顆粒製劑,可由於腫瘤特有的強化的通透性和滯留性(EPR)效應導致藥物在腫瘤微環境中得以積累。在使用HuCCT-1細胞移植瘤模型的動物藥效研究中,STP705給藥治療的小鼠,以劑量依賴的方式抑制腫瘤生長。
關於【孤兒藥】資格認定
美國FDA的孤兒藥法案(ODA)規定,對於贊助商/開發商用於治療罕見疾病或病症的藥物或生物製品(“藥物”)給予特殊身份。這種狀態被稱為“孤兒認定”(或“孤兒狀態”)。對於一種符合孤兒名稱的藥物,藥物和疾病或條件必須符合ODA和FDA實施條例中規定的21 CFR第316部分中的某些標準。獲得孤兒指定資格的藥物贊助商/開發商,可以得到DOA提供的各種發展資助,包括對開展合格臨床試驗的行為進行稅收抵免。

關於聖諾制藥公司
聖諾制藥(Sirnaomics)公司是一家高科技生物制藥集團企業,通過RNAi技術進行新藥研發創新,總部位於美國馬里蘭州蓋瑟斯堡,在特拉華州註冊,並在中國設立蘇州聖諾和廣州納泰兩家子公司。該公司的使命是開發新的藥物和療法,用以減輕人類痛苦,並在遠未滿足醫療需求的地區推進對病人的健康護理。公司宗旨是:創新引領、全球視野、病患第一。公司高級管理團隊成員在中美兩國生物制藥、財務、臨床和商業管理方面具有豐富經驗。聖諾制藥公司得到了大量機構投資者、企業合作夥伴和政府補助資金的支持。聖諾制藥已經建立了一個強大的知識產權組合和豐富的產品管線。治療的重點領域包括抗纖維化和抗癌治療,以及其他疾病領域。
聯繫方式:
聖諾制藥中國區首席科學家
路陽博士
alu@sirnaomics.com





 返回新聞發佈
返回新聞發佈
 上一頁
上一頁
