聖諾公司核酸干擾新藥STP705又獲FDA一孤兒藥認定批准

全球領先的核酸干擾(RNAi)新藥創制及臨床研發企業 — 聖諾制藥公司(Sirnaomics Inc)日前發佈新聞:公司自主研發首推的核酸干擾創新藥STP705再次被美國FDA罕見病產品開發辦公室(Officeof Orphan Product Development Division)授予治療膽管癌(Cholangiocarcinoma)的孤兒藥認定(Orphan Drug Designation)。這是繼該藥於今年8月份被美國FDA認定為治療原發硬化性膽管炎(Primary Sclerosing Cholangitis - PSC)的孤兒藥之後又一重大突破,為聖諾公司加快開發新藥STF705針對此類適應症的有效治療藥物提供快速通道。
聖諾公司開發的1.1類化藥STP705,是一種具有抗組織纖維化和抗炎症治療效果的“全球新”核酸干擾藥物。再次獲批FDA孤兒藥認證也是對這一新藥的又一權威認可。該藥採用兩個靶標TGF-β1和COX-2 siRNA寡核苷酸組成,發揮其組合同時抑制的協同優勢,採用組氨酸-賴氨酸共聚多肽納米顆粒(PNP)增強藥物的導入效率和安全性,直接高效阻斷纖維化和炎症反應的活性。這一藥物用於減少增生性瘢痕,已於去年獲得美國FDA和今年獲得中國CFDA的臨床批文,正在進行美國IIA期臨床試驗,中國臨床試驗正在展開。由於藥物作用機制明確,理論上對各種炎症和纖維化相關的疾病具有廣泛的適應性和良好的療效。

該藥本次獲得的FDA孤兒藥認定,是基於其在肝內膽管癌細胞系HuCCT-1的細胞培養實驗得到了有效的驗證。實驗表明可以顯著地對腫瘤細胞靶向抑制殺傷。更重要的是,在移植了腫瘤細胞HuCCT-1的小鼠的模型中,經過STP705注射治療後腫瘤有明顯減小和抑制。加之已有的用藥安全評價結果,得以獲得孤兒藥的認定批准。
“再度獲得美國FDA批准的孤兒藥認定,對聖諾制藥公司來說是又一非常重要的里程碑。這是過去一年內我們取得的第四項臨床研發的重大進展。前三項是STP705用於增生性瘢痕治療獲得美國FDA、中國CFDA的臨床批准和治療原發硬化性膽管炎(PSC)的孤兒藥認證。新藥STP705抗組織纖維化和抗炎症治療的特性有望儘快給膽管癌和其他類惡性腫瘤疾病患者帶來有效的治療手段。”
- 陸陽博士 (Dr. Patrick Lu)
總裁、CEO, 聖諾制藥創始人
“美國FDA孤兒藥同年再度獲批認證,是對於聖諾新藥STP705針對這類惡性疾病治療的又一正面肯定。聖諾公司將持續推動產品鏈中各項創新藥的臨床研究,計畫在2018年上半年申報CCA的美國FDA新藥IND和中國CFDA新藥IND, 儘快開展臨床研究。早日實現為疾病患者提供有效的治療手段。”
- 邁克爾•莫裏諾博士(Dr. Michael Molyneaux)
聖諾制藥CMO首席醫學官
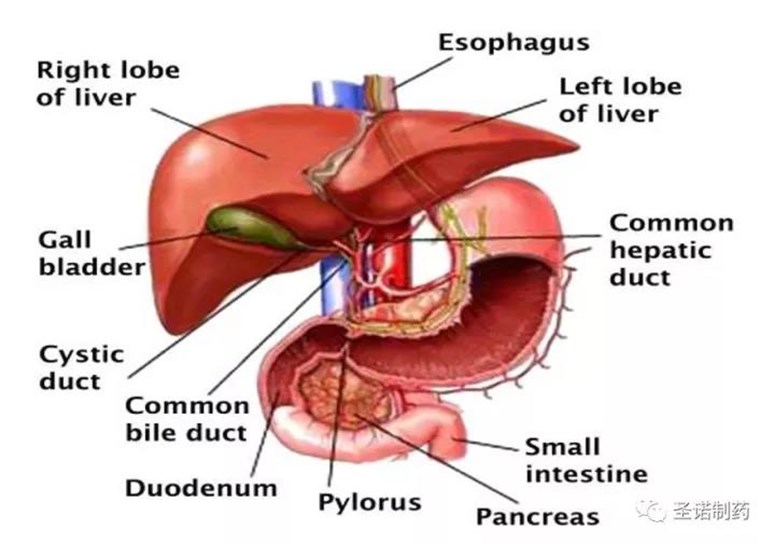
關於膽管癌(Cholangiocarcinoma- CCA)
膽管癌(Cholangiocarcinoma或稱Bile DuctCancer)也稱膽道癌,一般是指原發於膽總管上端至膽總管下端的,由膽道上皮細胞或呈現上皮細胞分化特徵的細胞突變而引起的肝外膽管惡性腫瘤。膽管癌的發病通常發現已經為中晚期,整體的五年生存率在2-30%.目前,膽管癌在世界範圍內沒有有效的治療手段。目前唯一可用於治癒膽管癌的療法是採用手術切除原發性膽管腫瘤,但由於多數患者在診斷出膽管癌時已經為晚期,所以很難提供有效的手術切除。
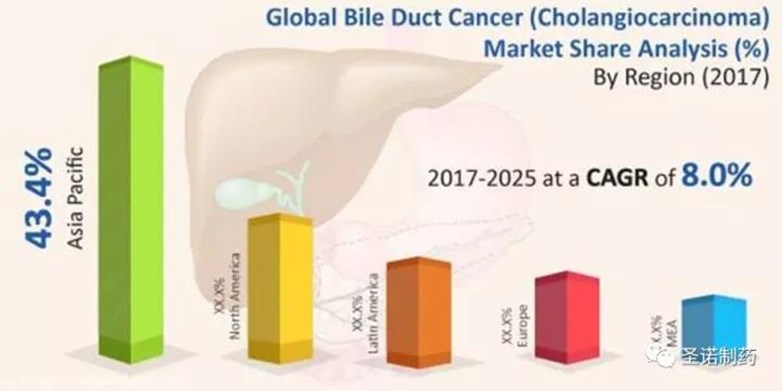
最新的市場份額分析預測顯示:2017-2025年,膽管癌治療的複合年均增長率(CompoundAnnual Growth Rate – CAGR)將達到8%;其中亞太地區的份額最高,將達43%以上。聖諾公司STP705核酸干擾藥物獲美國FDA認定批准為治療膽管癌治療的“孤兒藥”,必將加速推進這一核酸干擾創新藥的對於膽管癌臨床研究和全球開發,並有力促進其他類似組織纖維化疾病的開發和中美臨床應用。
關於STP705
STP705是由兩種分別靶向抑制轉化生長因數-β1(TGF-β1)和環氧化酶(COX-2)的mRNA 表達的siRNA寡聚核苷酸分子組成的藥物,採用組氨酸-賴氨酸共聚多肽(HKP)作為導入系統(輔料),製備成納米顆粒製劑。該藥物的每種siRNA都可有效抑制相應基因的表達,兩者聯合使用具有協同效應,可有效抑制促纖維化和促炎症因數的作用。分子生物學分析研究表明,抑制這兩個基因的表達還可以有效降低其下游與纖維化有關的基因的表達,包括α-SMA、Col1A1和Col3A1。此外,TGF-β1和COX-2表達下降會促進成纖維細胞和肌成纖維細胞的凋亡。因此,STP705理論上可以廣泛應用於各種炎症和纖維化疾病的治療。

關於孤兒藥認定
美國FDA的《孤兒藥法案》(ODA)於1983年獲國會批准,旨在授予只有個別贊助商開發的、用於治療罕見疾病或病徵的藥物或生物製品以特殊的法律狀態,這種法律狀態被稱為孤兒認定(有時也稱為“孤兒狀態”)。一個藥物要獲得孤兒藥認定,藥物本身和疾病或病徵都需要滿足ODA制定的標準,並符合FDA實施監管的《美國聯邦法規》第21章第316部分(21 CFR Part 316)的規定。孤兒藥認定使贊助商獲得了ODA對藥物各種開發資助,包括對被認定藥物實施臨床研究的稅收優惠。獲得孤兒藥認定之處方藥的市場應用不受處方藥用戶費用的限制,除非該藥物還包括除了罕見疾病或病症之外的其他指症。
關於聖諾制藥公司
聖諾制藥公司(Sirnaomics Inc.)是全球領先的專注於核酸干擾(RNAi)藥物研發和產業化開發的生物醫藥企業,總部位於美國馬里蘭州蓋瑟斯堡,在中國的蘇州和廣州分別建有研發中心和中試生產基地。聖諾公司以開發創新藥物、滿足重大疾病人群的治療需求、減輕病人痛苦、提高公眾健康為使命。聖諾制藥的高層管理團隊具有廣泛而豐富的生物醫藥企業運營和管理、臨床研究和商業發展的經驗,公司在美國和中國均獲得大量政府科技資金、專案合作資金以及私募資金的支持。聖諾制藥公司通過自主創新構建了堅實的知識產權保護體系,並已形成了強大的產品管線,治療領域包括抗纖維化、抗炎症和抗癌症等諸方面。





 返回新聞發佈
返回新聞發佈
 上一頁
上一頁
